http://dx.doi.org/10.5762/KAIS.2016.17.7.182 ISSN 1975-4701 / eISSN 2288-4688
Journal of the Korea Academia-Industrial cooperation Society Vol. 17, No. 7 pp. 182-191, 2016
고압처리와 단백질 분해효소를 이용한 연산오계 다리육 펩타이드 생산 최적화 및 특성 분석
Abstract
The purpose of this research was the optimization of protein hydrolysate production using a commercial enzyme bromelain 1200 derived from the leg of Yeonsan Ogae by response surface methodology. Yeonsan Ogae has long been known as supporting health and high efficacy treatment. In recent days, as the efficacy of functional peptides becomes more known, optimization of oligopeptide production and its characteristics from Ogae leg meat has been performed. Response surface methodology was performed for optimization of enzyme hydrolysis. The process was varied in pressure (30 to 100 MPa), time (1 to 3 h), and substrate concentration (10 to 30%). The degree of hydrolysis, amino acids, and molecular weight of products were analyzed. The optimum conditions were determined to be a pressure of 100 Mpa, time of 3 h, and substrate concentration of 20%. Under optimized conditions, degree of hydrolysis was 34.10%. The average molecular weight of protein hydrolysates was less than 1,000 Da. Major amino acids were leucine, lysine, alanine, glutamic acid, and phenylalanine. Keywords : Yeonsan Ogae, Protein, Hydrolysate, Optimization, Peptide
하유진, 김아연, 유선균 * 중부대학교 식품생명과학과 Optimization of Peptide Production from Leg Meat of Yeonsan Ogae by High Hydrostatic Pressure and Protein Hydrolytic Enzyme and Its Characteristic Analysis Yoo-jin Ha, A-Yeon Kim, Sun-Kyun Yoo * Department of Food and Biotechnology, Joongbu University 요 약 가금류 중에서 연산오계는 예로부터 다양한 효능 지닌 건강기능식품으로 알려져 있다 . 최근 육질 단백질로부터 유래 한 기능성 펩타이드에 대한 연구가 활발하게 진행 되어 본 연구는 오계 다리육으로부터 표면 반응 분석을 이용하여 최적 공정을 수행하였다 . 상업용 단백질 가수분해 효소 bromelain 1200 을 이용하여 오계 다리육 단백질로부터 펩타이드 분자량을 가지는 단백질 가수 분해물 최적 제조 공정 조건을 표면반응 분석법을 이용하여 수행을 하였다 . 제조 공정 변수들은 범위는 압력 (30-100 MPa), 반응시간 (1-3 시간 ), 반응 기질 양 (10- 30%) 이었다 . 가수분해도 최적 조건은 압력은 높을수록 증가를 하였 고 , 반응 시간은 시간은 3 시간 , 기질의 농도는 20% 에서 결정이 되었다 . 이때 최대 가수분해도가 34.10% 이였다 . 단백질 가수 분해물은 대부분 펩타이드의 분자량인 1,000 이하의 분자량 분포를 보여 주었다 . 펩타이드의 유리 아미노산들의 함량은 leucine, lysine, alanine, glutamic acid, phenylalanine 순으로 존재하였고 , 구성아미노산을 제외한 아미노산에서는 taurine(4.9%), ornitine(1.8%), anserine(1.6%), hydroxylysine(1.4%) 등의 순으로 존재하였다 .
1. 서론
진을 목적으로 다양한 기능성 식품 원료 개발이 활발하 게 진행되고 있다[1]. 기능성 원료들 중에서 펩타이드는 항산화 효과, 면역 본 연구는 농림축산식품부고부가 식품기술개발사업 (314040-30-1-HD030)에 의해 이루어진 것임 * Corresponding Author : Sun Kyun Yoo (Joongbu Univ.) Tel: +82-41-750-6206 email: Received May 9, 2016 Revised (1st July 5, 2016, 2nd July 6, 2016) Accepted July 7, 2016 Published July 31, 2016
기능, 고혈압 예방 등 생리활성 기능이 높은 것으로 보고 전까지–20°C에서 냉동 보관하였다. trichloroacetic 되고 있으며, 이러한 기능성으로 인해 노화를 억제시킬 acid(TCA)시약과 Foli n ciocalteu`s phenol(FCP)시약은 수 있는 물질로 여겨지고 있다[2, 3]. Sigma Comp any 사(Seoul, Korea)에서 구입하였고, 단 이러한 기능성 펩타이드는 주로 동물성 단백질을 가 백질 분해효소 bromelain 1200GDU(BM 1200)은 대종 수분해하여 생산하고 있는데, 최근 가금류에 관련된 것 상사(Seoul, Korea)에서 구입하였다. 효소의 역가를 측 으로 닭 가공 공정 부산물 단백질, 닭 가슴살 단백질, 닭 정하기 위한 단백질은 카제인으로 대정화금(Daejeon, 날개 단백질, 난 단백질, 닭 피부 단백질로부터 기능성 Korea)에서 구입하였다. 펩타이드 생산 및 생리활성에 대한 연구들이 발표되고 있다[4, 5, 6, 7, 8, 9, 10]. 2.2 오계 다리육 분리 및 균질화 가금류 중에서 오골계는 예로부터 다양한 생리활성을 냉동된 오계 다리육을 40°C 항온수조에서 동안 지닌 것으로 알려져 왔다. 오골계 육으로부터 생산된 올 해동한 후에 뼈와 분리하여 용기에 담고 고기갈개 리고 펩타이드는 항고혈압 효과가 있는 것으로 보고되었 (Kenwood, Seoul, Korea)를 이용하여 골고루 다진 후 다[11]. 파파인으로부터 추출된 프로티아제는 오계육으 분쇄된 오계 다리육을 지퍼백에 넣고 –20°C에서 냉동 로부터 항산화 기능을 지닌 펩타이드를 생산하였다[12]. 보관하였다. 오골계 중에서 연산오계는 한국 재래종으로서 1980년 천연기념물 265호로 지정이 되었으며, 연산 오계육의 생 2.3 고압 처리한 오계 다리육 펩타이드 생산 리활성에 대한 대부분의 연구들은 증탕액에 대한 것으로 최적화 공정 지질대사 개선, 조골세포 분화 및 파골세포 분화억제, 면 펩타이드 생산 최적화 공정을 위한 실험 계획은 역개선 등의 효능이 발표되었다[13, 14, 15, 16]. 그러나 연산오 의 독립변수 반응압력(MPa), 반응시간(h), 기질의 농도 계육 단백질로부터 유래된 펩타이드에 대한 연구들을 미 즉, 오계 다리육 농도(%)를 각각 50 MPa, 3시간, 20%로 비한 실정이다. 하는 Center run을 5번 반복을 포함하여 총 17개의 처리 펩타이드 형태의 단백질 가수 분해물을 제조하는 방 조합으로 구성 되었다. Box-Behnken Design은 세 가지 법 중에서 효소를 이용하여 제조하는 것이 기능성 및 의 중요한 절차에 따라 진행이 되는데, 첫째는 계획된 실 안전성이 높다고 보고된 바가 있다[17, 18]. 최근 효소에 험(designed experiment)에 따라 통계적으로 실험을 수 의한 단백질 가수분해는 고압(high hydrostatic pressure) 행하고, 둘째는 수식 모델의 계수(coeff 환경에서 활성이 향상된다고 한다. 고압처리는 우유 단 model)를 구하고, 셋째는 모델의 적합성을 판정하는 것 백질에 펩신, 트립신 및 키모트립신과 같은 효소를 처리 으로 진행이 된다[24]. 본 실험에서는 반응 변수는 가수 할 때 가수분해 속도를 증가 시켰고[19], 또한 고압 처리 분해도(DH, Degree of Hydrolysis)로 하였고, 통계적인 하여 생산된 육류 등 식품 소재들의 기능성이 활성화 되 계산을 원활하기 위하여 독립 변수를 다음과 같이 표준 었다[20, 21, 22, 23]. 화(code)하여 사용하였다. 세 개의 변수들을 각각 따라서 본 연구는 오계 다리 육으로부터 펩타이드 형 력), X 2 (시간), X 3 (기질농도)로 하였다. 표준화의 값들은 태의 단백질 가수 분해물 최적 생산 공정 조건을 연구하 다음과 같은 공식에 의하여 구할 수 있고 그 값을 고 생산물의 특성(가수분해도, 유리아미노산, 분자량 분 하였다. 포)을 연구하였다.
2. 재료 및 방법
X o 는 표준화 값의 중심 값이고 표준화 값이다. △X는 1 단위만큼의 증가 또는 감소하는 값의 크기이다. 2.1 실험재료 실험결과에 대한 분석은 표면 반응 분석법으로 사용을 본 실험에 사용된 오계육은 지산농원(Nonsan, Choongnam, 하였으며 최적 공정 조건을 나타내는 다중 회귀식은 다 Korea)에서 깃털이 없이 냉동상태로 공급되었고, 실험 음과 같다.
20분
3개 icients of X 1 (압 Z로 (1) X는
여기서 Y는 Predicted response이고 본 실험처럼 3개의 변수가 있을 경우에는 k값이 3이 되고 궁극적으로 다음 과 같은 식으로 표현된다.
실험 후에 확정된 결과들의 통계분석은 Des ign Expert(Couresy: Statease Inc., Statistics Made Easy, Minneapolis, USA)를 사용하였다. 독립변수들의 값은 예비 실험에서 얻은 결과로부터 선택하여 X 1 (압력)는 30 MPa(-1), 50 M Pa(0), 100 MPa(+1)로 정하고, X 2 (시간) 는 1시간(-1), 3시간(0) 5시간(+1)로 정하고, X 3 (기질의 농도)는 10%(-1), 20%(0), 30%(+1)로 정하였다(Table 1).
2.4 오계 다리육 단백질 가수분해 플라스틱 비커에 30 mL PBS 용액와 오계 다리육을 10%, 20%, 30%씩 각각 넣어 Homoge nizer를 이용하여 균질화 시켰다. 진공파우치에 균질화 된 다리육과 효소 BM 1200 1%를 첨가하여 고압기(TFS–2L, Toyoko Tasu Co., LTD, Hiroshima, Japan)에 반응시켰다. 반응 후 100°C의 항온수조에 30분 동안 넣고 효소활성을 정 지시킨 후 냉동 보관하였다. Tube에 샘플 2.5 mL와 0.3 M TCA(trichloroacetic acid) 5 mL를 넣고 상온에서 20 분 반응 후 3000 rpm에서 10분간 원심분리 한 다음 상 등액을 취하여 침전된 단백질을 분리하였다. 2.5 가수분해도 측정 가수분해도 측정은 Lowry법을 변형하여 측정하였다 [25]. 오계 다리육의 단백질 가수 분해물 1 mL에 0.5 N
NaOH 5 mL, 1 N FCP(Folin-cio calteu`s phenol reagent) 1 mL를 넣고 Voltex로 즉시 혼합하여 배양기에 30°C에 서 15분 동안 반응하였다. 반응 후 샘플을 여과하여 578 nm에서 흡광도를 측정하였다. 표준물질인 L-tyrosine의 표준곡선을 이용하여 가수분해도 DH(%)를 계산하였다. 2.6 아미노산 분석 PBS용액 30 mL에 오계 다리육 9 g을 넣어 분쇄한 후 효소 BM1200를 1% 사용하여 500 MPa에서 5시간 반응하고 3,000 rpm에서 20분간 원심분리 하여 상등액 을 취하였다. 상등액은 0.2 μm membrane filter (Millipore Co., MA, USA)로 여과하여 아미노산 자동분 석기(Sykam GmbH, S430-H, Germany)로 아미노산량 을 측정하였다. column은 Cation separation column (LCA K07/Li)을 사용하였고, 크기는 4.6 × 150 mm, 온 도는 37~74°C, 완충용액과 o-Phthalal aldehyde(OPA) 시약의 flow rate는 각각 0.45 mL/min, 0.25 mL/min이 었으며, 이때 완충용액의 pH 범위는 2.90~7.95이었고, 파장은 440 nm과 570 nm이었다. 2.7 단백질 가수분해물 분자량 측정 PBS용매 30 mL에 오계 다리육 9 g을 넣어 분쇄한 후 효소 BM 1200 1%를 사용하여 50 MPa에서 5시간 반응하고 3,000 rpm에서 20분간 원심분리 하여 상등액 을 취하였다. 상등액은 0.2 μm membrane filter(Millipore Co., MA, USA)을 이용하여 여과한 샘플을 사용하였다. 펩타이드 분자량 측정을 위해 matrix는 alpha-cyano -4-hydroxy -cinnamic acid 1 mg을 0.1 mL 70% acetonitrile, 0.1% formic acid에 용해 후 만들었다. 샘플의 농도는 50~ 100 ppm 정도로 준비하였으며, matrix시료와 시료를 1:1비율로 섞었다. MS plate위에 1 mL 정도 떨어뜨려 건조한 후 노란색을 띄는 샘플을 취해 질량분석기 (MALDI-TOF, Voyager DE-STR, Applied biosystems, Foster City, CA, USA)를 이용하여 분석하였다.
3. 결과 및 고찰
3.1 고압 처리한 오계 다리육 단백질의 펩타이드 생산 최적화 공정 BM1200에 효소를 이용하여 오계 다리육을 효소가수 분해 하여 최적 조건요인들인 압력, 시간, 기질의 양의
실험변수에 대하여 Box-Behnken Design으로 실험을 설 계하여 얻어진 실험결과 즉, 가수분해도를 Table 2에 나 타내었다. 가수분해도의 범위는 16.70%~34.10%으로 측정되었고, 최대 예측 가수 분해도가 34.10%로 보여 진다.
실험결과를 이용한 회귀식 대한 분산분석의 결과는 반응표면분석법에 의해 수립된 모델의 적합성 여부를 알 려준다. 다중반응표면 최적화는 다수의 반응변수를 최적 화하는 입력변수의 조건을 찾는 것을 목적으로 한다 회기 모델의 분석 결과는 나 타내었다. 이들의 결과에 따르면 가수분해도가 압력과 시간과 기질에 영향을 받는다는 것이 수준 이내에 서 인정되었다.
Table 3. Analysis of variance(ANOVA) for fitted second-order polynomial model and lack of fit for black body fowl(Ogae) leg meat. Sum of Squares Source DF DH a Model 9 549.03 b Residual 7 21.31 Lack of Fit 3 2.68 Pure Error 4 18.63 Cor Total 16 570.34 a Coefficient of correlation (R 2 ) for black body fowl(Ogae) leg meat was 0.96. b Significant at 5% level.
모델 결정계수(determination coefficient) R 2 값은 실 험값(observed value)와 예측값(predicted value)과 상호 연관(correlation) 정도를 보여주는데 가수분해도 0.9626 이므로 이 모델은 4% 범위에서 설명되지 않는다는 것을 보여준다. 적합결여(lack of fit) 테스트 검정에서는 유의 성이 나타나지 않아 본 실험에 사용한 모델이 매우 적절 함을 알 수 있다. Table 4에서는 모델의 회귀계수를 나 타내는 것으로 가수분해도가 3가지 요인 즉 압력, 시간, 기질들에 대하여 크게 영향을 받는 것으로 나타났다 (P<0.05). 본 실험 결과는 압력, 시간, 기질의 양에 대한 영향은 1차, 2차, 교호항(cross product term)에서 유의 성이 나타나 요인들이 단독 또는 교호적으로 영향을 미 침을 알 수 있다. 이들에 대한 회귀식은 Table 5에 있다.
Response Second oder polynomial equations R 2 Y = +31.96+4.26X 1 +2.39X 2 +1.43X 3 Hydrolysis(%) -3.34X 1 2-6.79X 2 2-2.67X 3 2 0.96 +0.98X 1 X 2 +2.65X 1 X 3 +1.85X 2 X 3 X 1 : Pressure (MPa) X 2 : Time (h) X 3 : Substrate concentration (%)
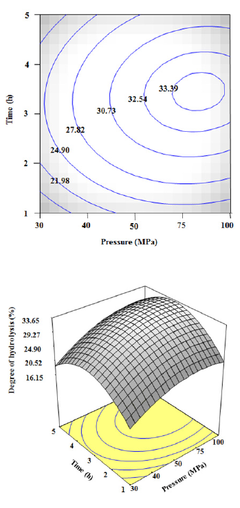
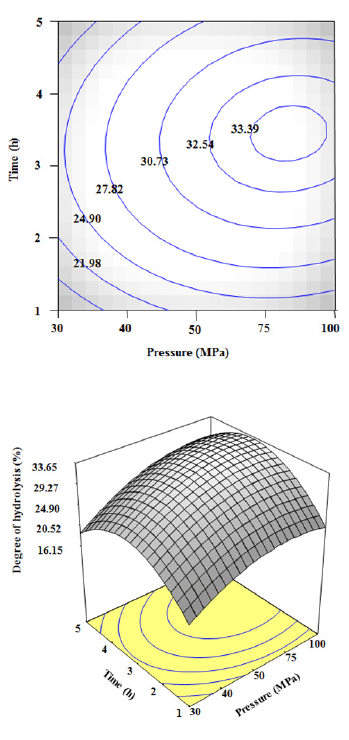
3.2 압력과 시간에 따른 펩타이드 생산 압력과 시간에 따른 펩타이드 생산의 최적 표면 반응 분석결과는 Fig. 1에서 보여 진다. 압력 80 MPa와 3시
Fig. 1에서
80 MPa와 3시
간 30분 반응하였을 때 펩타이드 생산량이 최대치가 나 타났다. 압력과 시간에 따른 가수분해는 비슷한 경향을 보여 지며 압력에 비해 시간에 조금 더 영향을 받는 것 으로 보여 진다. 압력은 30 MPa부터 80 MPa까지 증가 하다가 그 이후에는 감소하기 시작하는 결과를 보여주었 다. 시간 또한 비슷하게 1시간부터 3시간 30분까지 증가 하다가 그 이후에는 감소하는 결과를 보여주었다. 가수 분해도의 범위는 16.15%~33.65%으로 나타났으며, 가 수분해도는 펩타이드 생산량을 평가하는 지표가 되므로 최대 예측 펩타이드 생산량은 33.65%로 보여 진다.
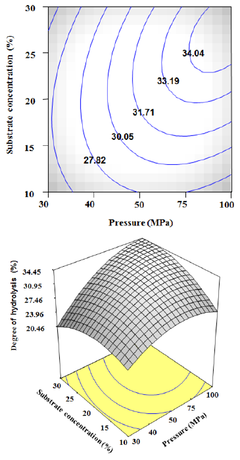
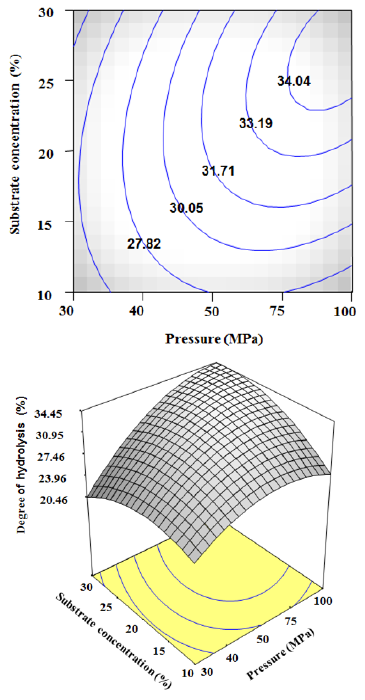
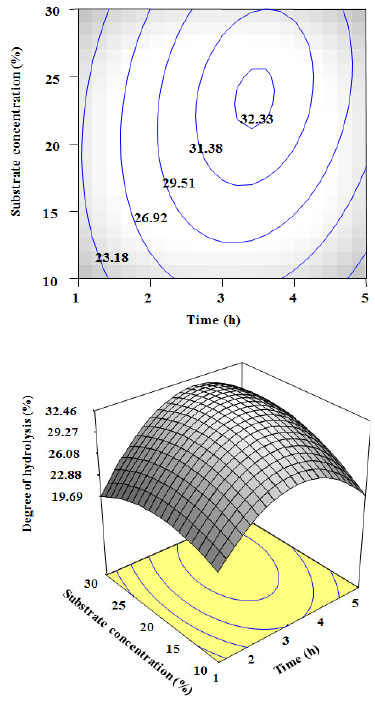
3.4 압력과 기질의 농도에 따른 펩타이드 생산 압력과 기질의 농도에 따른 펩타이드 생산의 최적 표 면 반응 분석결과는 Fig. 2에서 보여 진다. 기질의 농도 27%와 압력 80 MPa로 반응 하였을 때 펩타이드 생산량 이 최대치가 나타났다. 압력과 시간에 따른 가수분해는 비슷한 경향을 보여 지며 기질의 농도보다는 압력에 더 큰 영향을 받는 것으로 보여 진다. 압력은 30 MPa부터 80 MPa까지 증가하다가 그 이후에는 감소하기 시작하 는 결과를 보여주었다. 기질의 농도 또한 비슷하게 10% 부터 27%까지 증가하다가 그 이후에는 감소하는 결과 를 보여주었다. 가수분해도의 범위는 20.46%~34.45% 으로 최대 예측 펩타이드 생산량은 34.45%로 보여 진다.
면 반응 분석결과는 Fig. 3에서 23%와 3시간 30분 반응
1시간부
3시간 30분까지
10%부터 23%까지
32.46%으로
19.69%~ 32.46%로 보
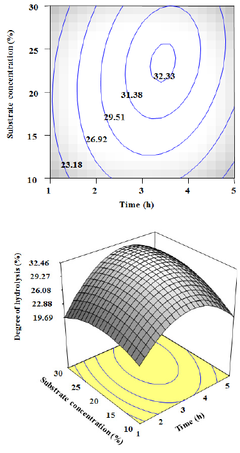
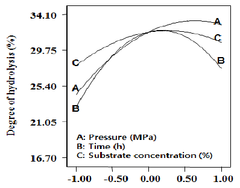
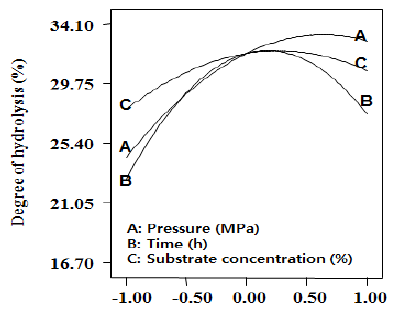
3.5 시간과 기질의 농도에 따른 펩타이드 생산 3.6 가수분해도 측정 시간과 기질의 농도에 따른 펩타이드 생산의 최적 표 표면 반응의 분석결과 정상점(stationary point)이 최 면 반응 분석결과는 Fig. 3에서 보여 진다. 기질의 농도 대점으로 판명되어 예측 최대 고압 처리한 오계다리살의 23%와 3시간 30분 반응 하였을 때 펩타이드 생산량이 단백질 효소가수분해는 압력이 높을수록, 반응시간이 많 최대치가 나타났다. 기질의 농도와 시간에 따른 가수분 을수록, 기질양이 많이 사용될수록 영향을 받는 것으로 해는 비슷한 경향을 보여 지며 기질의 농도보다는 시간 나타났다. 압력은 높을수록 점차 증가되면서 가수분해가 에 더 큰 영향을 받는 것으로 보여 진다. 시간은 1시간부 더욱 잘 된 것을 보여주었다. 시간은 3시간 반응 하였을 터 3시간 30분까지 증가하다가 그 이후에는 감소하기 때 최고 고압액화 가수분해 정도를 보여주다가 시간이 시작하는 결과를 보여주었다. 기질의 농도 또한 비슷하 더 지날수록 가수분해도가 낮아지는 것을 보여준다. 기 게 10%부터 23%까지 증가하다가 그 이후에는 감소하 질의 양은 10%보다 20%의 양일 때 일정하게 계속 증가 는 결과를 보여주었다. 가수분해도의 범위는 19.69%~ 하는 것을 보여주다가 30%의 양일 때 서서히 가수분해 32.46%으로 최대 예측 펩타이드 생산량은 32.46%로 보 가 줄어드는 것을 볼 수 있다. 최대 고압액화를 이용한 여 진다. 오계다리육의 가수분해는 34.10%이였다. 종합적으로 보 면 오계다리육의 고압액화 효소가수분해에 따른 펩타이 드 양에 가장 영향을 미치는 것은 압력이고 다음에 기질 의 농도 그리고 반응시간 순으로 나타났다(Fig. 4). Shon 등[27]은 닭고기 부산물을 이용하여 protease(Amano 6) 와 peptidase를 5:1의 비율로 효소 가수분해하였을 때 시 간이 지날수록 가수분해도가 급격히 증가하다가 점차적 으로 완만히 증가하는 것을 보여주었다. 이는 본 연구결 과와 일치하는 경향을 나타내었다.
point)이
3시간
10%보다 20%의 보여주다가 30%의
34.10%이였다.
4). Shon protease(Amano 6)
peptidase를 5:1의
6).
3.7 아미노산 분석 펩타이드 생성물의 유리 아미노산 함량은 다음과 같 다(Table 6). 고압 처리한 오계 다리육 단백질에서는 32 종류의 유리아미노산이 검출되었으며(344.80 mg/100g),
32 mg/100g),
구성 아미노산은 leucine, lysine, alanine, glutamic acid, phenylalanine 순으로 존재하였고, 구성아미노산을 제외 한 아미노산에서는 taurine(4.9%), ornitine(1.8%), anserine (1.6%), hydroxylysine(1.4%) 등의 순으로 존재하였다. 아미노산 함량은 식품의 기호성에 영향을 미치는 중요한 요소이고[28], 식품의 풍미를 예측하는 하나의 중요한 요소이다[29]. 또한 glutamic acid, aspartic acid, alanine 및 glycine 등은 식품의 향기와 맛을 부여하게 된다[30]. Fukunaga 등[31]은 일반 육계에 비하여 토종닭이 아미 노산의 함량이 많아 높은 기호도가 나타낸다고 하였으 며, Choe 등[32]은 토종닭에서 glycine, alanine 및 proline의 함량이 높았고 쓴맛을 지닌 phenylalanine[31] 의 함량에서는 토종닭보다 일반육계에서 높은 함량을 보 였다. 또한 Batzer 등[33]은 많은 아미노산들이 육류의 풍미에 관계되지만 tyrosine과 phenylalanine은 육류의 풍미에 관여하지는 않는다고 발표된 바 있다.
bromelain을 TCA를
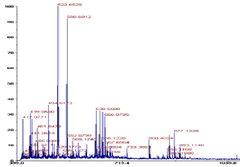
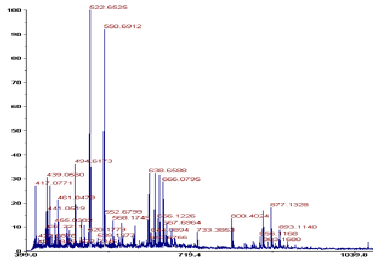
MALDI-TOP를 Fig. 5에서
m/z 400이상
1,000이하
1,000 Da
bromelain 효소를 500 Da
500 Da
pollock의
699 Da
3가지가
1305 Da, 938 Da, 584 Da이었다[37].
5 KDa
2-5 KDa
3.8 단백질 가수분해물 분자량 연산오계 다리육 단백질을 bromelain을 이용하여 최 적 고압 조건에서 단백질 가수분해하고 TCA를 이용하 여 가수 분해물을 추출을 하였다. 추출된 가수분해물의 분자량의 분포를 MALDI-TOP를 이용하여 분석한 크로 마토그램이 Fig. 5에서 보여준다. 크로마토그램은 대부 분 단백질 가수 분해물들의 분자량 분포는 m/z 400이상 에서 1,000이하 분자량 분포를 보여 주었다. 따라서 본 연구에서 생산된 단백질 가수 분해물은 1,000 Da 이하 의 펩타이드로 구성되었다는 것을 보여 준다[34]. 이와 같은 결과는 bromelain 효소를 이용하여 어류인 전갱이 단백질을 가수분해하여 500 Da 펩타이드가 생산 되었다는 기존의 보고와 유사하다[35]. 혈압 완화 효능 을 지닌 약 500 Da 트리 펩타이드가 pollock의 젤라틴 성분으로부터 생산되었다[36]. 다른 연구를 보면 새우 가공 부산물로부터 가수분해 물의 펩타이드를 동정한 결과 699 Da 의 평균 분자량을 가진 펩타이드가 보고되었다. 항산화 기능을 가진 펩타 이드 3가지가 참치육 가수 분해물로부터 생산이 되었는 데 분자량은 각각 1305 Da, 938 Da, 584 Da이었다[37]. 항바이러스 효능을 보이는 전갱이 단백질 가수 분해물은 5 KDa 이었다[38]. 닭 근육 단백질로부터 철분 결합력 을 가지는 주요 가수 분해물은 2-5 KDa 로 보고하였다 [39].
[39].
4. 결론
상업용 단백질 가수분해 효소 bromelain 1200을 이용 하여 오계 다리육 단백질로부터 펩타이드 분자량을 가지 는 단백질 가수 분해물 최적 제조 공정 조건을 표면반응 분석법을 이용하여 수행을 하였다. 제조 공정 변수들은 범위는 압력(30-100 MPa), 반응시간(1-3시간), 반응 기 질 양(10-30%) 이었다. 가수분해도 최적 조건은 압력은 높을수록 증가를 하였고, 반응 시간은 시간은 3시간, 기 질의 농도는 20%에서 결정되었다. 이때 최대 가수분해 도가 34.10%이였다. 단백질 가수 분해물은 대부분 펩타 이드의 분자량인 1,000이하의 분자량 분포를 보여 주었다. 펩타이드들의 유리 아미노산들의 함량은 leucine, lysine, alanine, glutamic acid, phenylalanine 순으로 존재하였고, 구성아미노산을 제외한 아미노산에서는 taurine(4.9%), ornitine(1.8%), anserine(1.6%), hydroxylysine(1.4%) 등 의 순으로 존재하였다.
References
- [1] T. J. Lee, K. J. Min, “The effect of Allium sativum L. extract on hepatic function in rats with CCl4-induced (hepatic) injury”, Journal of the Korea Academia-Industrial cooperation Society, Vol. 11, pp. 1936-1942, 2010. [DOI]
- [2] A. L. McCarthy, Y. C. O’Callaghan, N. M. O’Brien, “Protein Hydrolysates from Agricultural Crops - Bioactivity and Potential for Functional Food Development”, Agriculture, Vol 3, pp 112-130, 2013. DOI: http://dx.doi.org/10.3390/agriculture3010112 [DOI]
- [3] L. Qing, Li Yi, M. Peter, I. Brent L., “Commercial proteases: Present and future”, FEBS Letters, Vol. 587, pp. 1155-1163, 2013. DOI: http://dx.doi.org/10.1016/j.febslet.2012.12.019 [DOI]
- [4] K. Elavarasan, B. A. Shamasundar, B. Faraha, H. Howell, “Angiotensin I-converting enzyme (ACE) inhibitory activity and structural properties of oven- and freeze-dried protein hydrolysate from fresh water fish (Cirrhinus mrigala)”, Food Chemistry, Vol. 206, pp. 210-216, 2016. DOI: http://dx.doi.org/10.1016/j.foodchem.2016.03.047 [DOI]
- [5] S. Jain, A. K. Anal, “Optimization of extraction of functional protein hydrolysates from chicken egg shell membrane (ESM) by ultrasonic assisted extraction (UAE) and enzymatic hydrolysis”, LWT - Food Science and Technology, Vol. 69, pp. 295-302, 2016. [DOI]
- [6] I. V. Nikolaev, S. Sforza, F. Lambertini, D. Y. Ismailova, V. P. Khotchenkov, V. G. Volik, A. Dossena, V. O. Popov, O. V. Koroleva, “Biocatalytic conversion of poultry processing leftovers: Optimization of hydrolytic conditions and peptide hydrolysate characterization”, Food Chemistry, Vol. 197, pp. 611-621, 2016. DOI: http://dx.doi.org/10.1016/j.foodchem.2015.10.114 [DOI]
- [7] Y. Y. Sun, D. D. Pan, Y. X. Guo, J. J. Li, “Purification of chicken breast protein hydrolysate and analysis of its antioxidant activity”, Food and Chemical Toxicology, Vol. 50, pp. 3397-3404, 2012. DOI: http://dx.doi.org/10.1016/j.fct.2012.07.047 [DOI]
- [8] T. Mesut, E. Nevzat, O Serkan, “Efficient production of l-lactic acid from chicken feather protein hydrolysate and sugar beet molasses by the newly isolated Rhizopus oryzae TS-61Original”, Food and Bioproducts Processing, Vol. 90, pp. 773-779, 2012. DOI: http://dx.doi.org/10.1016/j.fbp.2012.05.003 [DOI]
- [9] F. Nahed, K. Naourez, H. Anissa, H. M. Ibtissem, D. Ines, N. Moncef, “Total solubilisation of the chicken feathers by fermentation with a keratinolytic bacterium, Bacillus pumilus A1, and the production of protein hydrolysate with high antioxidative activity”, Process Biochemistry, Vol. 46, pp. 1731-1737, 2012. [DOI]
- [10] O. John O., G. Abraham T., M. Sunday A., A. Rotimi E., A. Michel, “Kinetics of in vitro renin and angiotensin converting enzyme inhibition by chicken skin protein hydrolysates and their blood pressure lowering effects in spontaneously hypertensive rats”, Journal of Functional Foods, Vol. 14, pp. 133-143, 2015. DOI: http://dx.doi.org/10.1016/j.jff.2015.01.031 [DOI]
- [11] R. Z. Gu, W. Y. Liu, F. Lin, Z. T. Jin, L. Chen, W. X. Yi, J. Lu, M. Y. Cai, “Antioxidant and angiotensin I-converting enzyme inhibitory properties of oligopeptides derived from black-bone silky fowl (Gallus gallus domesticus Brisson) muscle”, Food Research International, Vol. 49, pp. 326-333, 2012. DOI: http://dx.doi.org/10.1016/j.foodres.2012.07.009 [DOI]
- [12] J. H. Liu, Y. G. Tian, Y. Wang, S. P Nie, M. Y. Xie, S. Zhu, C. Y. Wang, P Zhang, “Characterization and in vitro antioxidation of papain hydrolysate from black-bone silky fowl (Gallus gallus domesticus Brisson) muscle and its fractions”, Food Research International, Vol. 44, pp. 133-138, 2011. DOI: http://dx.doi.org/10.1016/j.foodres.2010.10.050 [DOI]
- [13] H. S. Chae, Y. M. Yoo, C. N. Ahn, S. H. Cho, B. D. Sang, Y. G. Kim, J. M. Lee, S. K. Yun, Y. I. Choi, “Feeding Effects of the High Pressure Boiled Extract(HPBE) of the Ogol Chicken on Weight Gain and Serum Lipid Composition of Rat”, Korean J Poult Sci, Vol. 30, PP. 135-143, 2003. [possible DOI] [alternative DOI]
- [14] H. S. Chae, Y. M. Yoo, C. N. Ahn, S. H. Cho, B. Y. Park, J. M. Lee, Y. K. Kim, S. G. Yun and Y. I. Choi, “Chemical and Sensory Characteristics of Boiled Soup Extracted from Crossbred Ogol Chicken as Affected by the Level of Flavourzyme”, Korean J Poult Sci, Vol. 30, PP. 11-16, 2003. [possible DOI] [alternative DOI]
- [15] H. S. Yoo, K. H. Chung, K. J. Lee, D. H. Kim, J. H. An, “Effect of Gallus gallus var. domesticus (Yeonsan ogolgye) Extracts on Osteoblast Differentiation and Osteoclast Formation”, Microbiol. Biotechnol. Lett. Vol. 43, pp. 322-329, 2015. DOI: http://dx.doi.org/10.4014/mbl.1508.08006 [DOI]
- [16] H. S. Chae, C. N. Ahn, Y. M. Yoo, J. S. Ham, J. M. Lee, S. K. Yoon, Y. I. Choi, “The Effects of the High Pressure Boiled Extracts (HPBE) of the Ogol Chicken with Herbs on the Hormones, Cytokine, Specific Antibody of Serum in the Rat”, Korean J Food Sci Anim Res., Vol. 24, pp. 283-292, 2004. [possible DOI] [alternative DOI]
- [17] W. J. Lahl, S. D. Braun, “Enzymatic production of protein hydrolysates for food use”, Food Technol, Vol. 48, pp. 68-71, 1994. [possible DOI] [alternative DOI]
- [18] R. D. Bernardini, P. Harnedy, D. Bolton, J. Kerry, E. O’Neill, A. M. Mullen, M. Hayes “Antioxidant and antimicrobial peptidic hydrolysates from muscle protein sources and by-products”, Food Chemistry, Vol. 124, pp. 1296-1307, 2011. DOI: http://dx.doi.org/10.1016/j.foodchem.2010.07.004 [DOI]
- [19] E. Penňas, G. Préstamo, R. Gomez, “High pressure and the enzymatic hydrolysis of soybean whey proteins, Food Chemistry, Vol. 85, pp. 641 – 648, 2004. DOI: http://dx.doi.org/10.1016/j.foodchem.2003.07.025 [DOI]
- [20] E. Peñas, G. Préstamo, F. Polo, R. Gomez, “Enzymatic proteolysis, under high pressure of soybean whey: Analysis of peptides and the allergen Gly m 1 in the hydrolysates”, Food Chemistry, Vol. 99, pp. 569 – 573, 2006. DOI: http://dx.doi.org/10.1016/j.foodchem.2005.08.028 [DOI]
- [21] D. Knorr, V. Heinz, R. Buckow, “High pressure application for food biopolymers”. Biochim. Biophys. Acta., Vol. 1764, pp. 619-631, 2006. DOI: http://dx.doi.org/10.1016/j.bbapap.2006.01.017 [DOI]
- [22] B. B. Bobonyaratanakornkit, C. B. Park, D. S. Clark. “Pressure effects on intra and intermolecular interactions within proteins”, Biochim. Biophys. Acta., Vol. 1595, pp. 235-249, 2002. DOI: http://dx.doi.org/10.1016/S0167-4838(01)00347-8 [possible DOI]
- [23] B. Bajovic, T. Bolmar, V. Heinz, “Quality considerations with high pressure processing of fresh and value added meat products”, Meat Sci., Vol. 92, pp. 280-289, 2012. DOI: http://dx.doi.org/10.1016/j.meatsci.2012.04.024 [DOI]
- [24] S. K. Hwang, J. T. Hong, K. H. Jung, B. C. Chang, K. S. Hwang, J. H. Shin, S. P. Yim, S. K. Yoo, “Process Optimization of Dextran Production by Leuconostoc sp. strain YSK. Isolated from Fermented Kimchi”, Journal of Life Science, Vol. 18, No. 10, 1377-1383, 2008. DOI: http://dx.doi.org/10.5352/JLS.2008.18.10.1377 [DOI]
- [25] O. H. Lowry, N. J. Rosebrough, A. L. Farr, R. J. Randall, “Protein measurement with the Folin phenol reagent”, J. Biol. Chem., Vol. 193, pp. 265-275, 1951. [DOI]
- [26] I. J. Jung, “A Weighted Mean Squared Error Approach Based on the Tchebycheff Metric in Multiresponse Optimization”, Journal of the Korea Academia-Industrial cooperation Society, Vol. 16, pp. 97-105, 2015. DOI: http://dx.doi.org/10.5762/KAIS.2015.16.1.97 [DOI]
- [27] S. H. Shon, I. H. Cho, Y. S. Kim, “Comparison of pyrazines formed in chicken by products hydrolyzed by Enzymes”, Korea J. Soc. Food Cookery Sci., Vol. 20, pp. 265-270, 2004. [possible DOI] [alternative DOI]
- [28] K. Watanabe, Y. Sato, “Meat flavor”, Japan J. Zootech Sci., Vol. 45, pp. 113-128, 1974. DOI: http://dx.doi.org/10.2508/chikusan.45.113 [possible DOI]
- [29] K. Rikimura, H. Takahashi, “Evaluation of the meat from Hinai-Jidon chicken and broilers: Analysis of general biochemical components, free amino acids, inosine-5'-monophosphate, and fatty acids”, J. Poult Res., Vol. 19, pp. 327-333, 2010. DOI: http://dx.doi.org/10.3382/japr.2010-00157 [DOI]
- [30] C. Ruiz-Capillas, A. Moral, “Changes in free amino acids during chilled storage of hake(Merluccius merluccius, L.) in controlled atmospheres and their use as a quality control index”, Eur. Food Res. Technol., Vol. 212, pp. 302-307, 2001. DOI: http://dx.doi.org/10.1007/s002170000232 [DOI]
- [31] T. Fukunaga, K. Koga, Y. Maita, S. Matsuoka S, “Free amino acid, carnosine and 5'-inosinic acid contents in the breast and leg meats from the cross and triple-cross chickens of Satsuma native fowl”, Bull Fac. Agric. Kagoshima Univ., Vol. 39, pp. 223-232, 1989. [possible DOI] [alternative DOI]
- [32] H. S. Choe, S. H. Cho, B. Y. Park, Y. M. Yoo, J. H. Kim, C. N. Ahn, J. M. Lee, Y. K. Kim, Y. G. Choi, “Changes of the fatty acid, amino acids and collagen contents in domestic broiler chickens of different marketing standard”, Korean J. Food Sci. Ani. Resour, Vol. 22, pp. 1-7, 2002. [possible DOI] [alternative DOI]
- [33] O. F. Batzer, A. T. Santoro, M. C. Tan, W. A. Landmann, B. S. Schweigert, “Precursors of beef flavor”, J. Agric Food Chem., Vol. 8, pp. 498-501, 1960. DOI: http://dx.doi.org/10.1021/jf60112a023 [DOI]
- [34] S. H. Kim, H. S. Nam, Y. J. Lee, “The study for the synthesis and analysis of metal chelated protein”, Journal of the Korea Academia-Industrial cooperation Society, Vol. 8, pp. 1273-1278, 2007. [possible DOI] [alternative DOI]
- [35] Z. Liu, K. L. Schey, “Optimization of a MALDI TOF-TOF Mass Spectrometer for Intact Protein Analysis”, J. Am. Soc. Mass Spectrom, Vol. 16, pp. 482-490, 2005. DOI: http://dx.doi.org/10.1016/j.jasms.2004.12.018 [DOI]
- [36] J. Salampessy, N. Reddy, K. Kailasapathy, M. Phillips, “Functional and protential therapeutic ACE-inhibitory peptides derived from bromelain hydrolysis of trevally proteins”, journal of funtional foods, Food Bioprocess Technol., Vol. 4, pp. 1527-1532, 2011. [DOI]
- [37] K. Hsu, G. Lu, C. Jao, “Antioxidative properties of peptides prepared fromtuna cooking juice hydrolysates with Orientase (Bacillus subtilis)”, Food Research International, Vol. 42, pp. 647-665, 2009. DOI: http://dx.doi.org/10.1016/j.foodres.2009.02.014 [DOI]
- [38] J. Adler-Nissen, “Enzymatid hydrolysis of proteins for increased solubility”, J Afric Food Chem, Vol. 24, pp. 1090-1093, 1976. DOI: http://dx.doi.org/10.1021/jf60208a021 [DOI]
- [39] D. A. Vattem, R. R. Mahoney, “Production of dialyzable iron by in vitro digestion of chicken muscleprotein fractions: the size of the dialyzable iron”, J Sci Food Agric, Vol. 85, pp. 1537-1542, 2005. DOI: http://dx.doi.org/10.1002/jsfa.2043 하 유 진 (Yoo-Jin Ha) [정회원] •2013년 2월 : 중부대학교 식품생명 과학과 (학사) •2013년 3월 ~ 현재 : 충남대학교 식품영양학과 (석사) <관심분야> 기능성 식품, 발효 김 아 연 (A-Yeon Kim) [정회원] •2013년 8월 : 중부대학교 식품생명 과학과 (이학학사) •2014년 11월 ~ 현재 : 중부대학교 식품생명과학과 <관심분야> 식품가공, 식품 미생물 유 선 균 (Sunl-Kyun Yoo) [정회원] •1993년 12월 : 미국 루이지애나 주 립대 식품과학과(석사) •1997년 12월 : 미국 루이지애나 주 립대 식품과학과(박사) •2001년 3월 ~ 현재 : 중부대학교 식품생명과학과 교수 <관심분야> 기능성식품, 발효 [DOI]